CGF(浓缩生长因子)是一种通过离心技术从自体血液中提取的高浓度生物活性物质,富含血小板、白细胞、纤维蛋白及多种生长因子(如PDGF、TGF-β、VEGF等),在牙科种植、骨缺损修复、皮肤再生及软组织愈合等领域应用广泛,其提取方法的核心是通过差异离心分离血液中的有形成分,富集高浓度生长因子与纤维蛋白基质,具体流程需严格遵循无菌操作与标准化步骤,以确保生物活性与安全性。
CGF提取前的准备
样本采集与预处理
CGF提取的样本为患者自体外周血,通常采集肘静脉血,采血量根据临床需求确定(如牙科种植一般采集5-10ml,骨缺损修复可能需10-20ml),采血前需患者空腹4-6小时,避免高脂饮食或剧烈运动,以防血液成分异常影响提取效率,采血时使用含抗凝剂(如ACD-A,枸橼酸葡萄糖溶液)的一次性真空采血管,抗凝剂与血液体积比通常为1:6(如5ml抗凝剂对应30ml血液),轻轻颠倒8-10次混匀,避免剧烈震荡导致血小板活化或溶血。
采血后需在2小时内完成提取,若无法立即处理,应将血液样本置于4-4℃冷藏(避免冷冻破坏血小板活性),保存时间不超过24小时,预处理时,将采血管再次轻柔混匀,确保抗凝剂充分分布,同时检查血液是否溶血(溶血会影响生长因子活性,需重新采血)。
CGF提取的核心步骤
CGF提取的核心设备为专用离心机(如Medifuge CGF离心机),其特点是可程序化控制离心速度与时间,通过“低速-高速-低速”的变速离心实现血液成分的分层分离,具体步骤如下:
第一阶段:低速离心(血浆与有形成分初步分离)
将预处理后的血液样本对称放入离心机吊篮(确保平衡,避免离心偏移),设置离心参数:
- 离心速度:2400-2700 rpm(相对离心力RCF约270-320 g);
- 离心时间:12-14分钟;
- 温度:室温(20-25℃,避免低温导致血小板活化)。
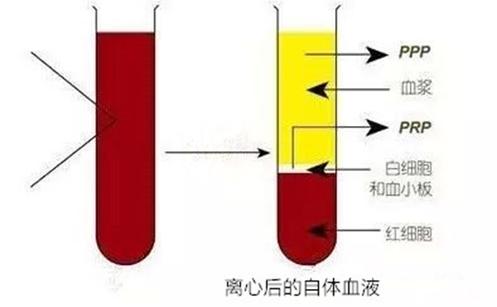
离心后血液形成三层分层:

- 上层:贫血小板血浆(PPP),呈淡黄色透明液体;
- 中层:白膜层(buffy coat),富含白细胞、血小板与部分纤维蛋白原;
- 下层:红细胞层(RBC),呈深红色。
此阶段目的是使红细胞沉降,保留富含血小板的中间层,为后续CGF富集奠定基础。
第二阶段:高速离心(CGF凝胶形成与生长因子富集)
离心结束后,小心取出离心管(避免震荡破坏分层),用移液管或专用吸管吸弃上层PPP(可单独收集用于其他治疗,如皮肤注射),保留中层白膜层与下层红细胞层(此时白膜层与红细胞层未完全分离),将离心管重新放入离心机,设置高速离心参数:
- 离心速度:2700-3200 rpm(RCF约340-480 g);
- 离心时间:10-12分钟;
- 温度:同上(室温)。
高速离心后,血液成分进一步分层:
- 上层:新分离的贫血小板血浆(PPP-2),更清澈;
- 中下层:形成CGF凝胶,呈乳白色或淡黄色胶状,由纤维蛋白网、血小板、白细胞及生长因子构成;
- 底层:红细胞(RBC),被压缩为致密的红细胞块。
此阶段的关键是高速离心使纤维蛋白原转化为纤维蛋白,形成三维网状结构,捕获血小板与白细胞,同时激活血小板脱颗粒释放生长因子,实现“凝胶化”富集。
第三阶段:低速离心(凝胶稳定与分层优化)
高速离心结束后,再次取出离心管,可观察到CGF凝胶与红细胞层之间形成清晰的分界线,将离心管放入离心机进行低速“塑形”离心:
- 离心速度:1400-1600 rpm(RCF约120-180 g);
- 离心时间:3-5分钟;
- 温度:室温。
此步骤通过低速离心使CGF凝胶进一步收缩、致密,与下层红细胞层分离更彻底,同时避免凝胶因震荡破碎,便于后续收集。
CGF组分的收集与制备
CGF凝胶的分离
低速离心结束后,用无菌镊子或离心管专用开启器小心打开离心管,可见三层结构:
- 上层:PPP-2(可弃用或备用);
- 中层:CGF凝胶(主体部分),质地柔软、弹性好;
- 下层:红细胞块(需彻底弃用,避免混入影响CGF纯度)。
用无菌手术剪刀或专用器械沿CGF凝胶与红细胞层交界处剪断,将CGF凝胶完整取出,置于无菌纱布或培养皿中,轻轻挤压排出残留的PPP(避免过度挤压破坏纤维蛋白网)。
CGF的制备形式
根据临床需求,CGF可制备为不同形式:
- CGF凝胶块:直接用于填充骨缺损、覆盖种植体或软组织缺损,提供生物支架与缓释生长因子;
- CGF膜:将CGF凝胶块平铺于无菌薄膜上,用压膜器压制为薄片,适合覆盖创面、引导组织再生;
- CGF液体:用无菌注射器吸取CGF凝胶中的少量液体(富含可溶性生长因子),用于局部注射或与其他材料(如骨粉、生物膜)混合使用;
- CGF碎屑:将CGF凝胶剪碎成1-2mm³颗粒,用于填充不规则缺损或混合自体骨。
关键参数与质量控制
CGF提取效果受多种参数影响,需严格控制以确保生物活性,以下是关键参数及其影响总结(表1):
| 参数 | 推荐范围 | 对CGF质量的影响 |
|---|---|---|
| 离心速度(rpm) | 第一阶段2400-2700;第二阶段2700-3200 | 速度过低:红细胞残留多,凝胶纯度低;速度过高:血小板过度活化,生长因子提前释放,凝胶结构破坏 |
| 离心时间(min) | 第一阶段12-14;第二阶段10-12;第三阶段3-5 | 时间过短:分层不彻底,富集效率低;时间过长:凝胶过度收缩,生长因子捕获量减少 |
| 抗凝剂比例 | ACD-A:血液=1:6 | 比例过高:抗凝剂残留,影响凝血与纤维蛋白形成;比例过低:血液凝固,无法离心分离 |
| 血液采集量 | 5-20ml(根据需求) | 量过少:CGF产量不足;量过多:离心负荷大,分层难度增加 |
| 温度 | 室温(20-25℃) | 低温(<4℃):血小板活性降低;高温(>30℃):生长因子稳定性下降 |
质量控制需检测以下指标:
- 血小板计数:理想浓度应≥全血血小板的3-5倍(通过血细胞分析仪检测);
- 生长因子浓度:ELISA法检测PDGF、TGF-β等,需显著高于普通血浆;
- 凝胶形成能力:观察凝胶弹性与完整性,易碎或分层提示提取失败。
不同应用场景的提取方法调整
不同临床应用对CGF的形态与成分需求不同,提取方法需针对性调整(表2):
| 应用场景 | 提取特点 | 制备形式 |
|---|---|---|
| 牙科种植 | 侧重骨结合与软组织封闭,需高浓度骨生长因子(如BMP、TGF-β) | CGF膜+CGF碎屑,覆盖种植体 |
| 骨缺损修复 | 需大体积骨再生,CGF与骨粉混合,提供支架与生长因子 | CGF碎屑与自体骨/骨粉混合 |
| 皮肤再生(瘢痕/溃疡) | 需表皮生长因子(EGF)与血管内皮生长因子(VEGF),促进上皮化与血管生成 | CGF液体注射+CGF膜覆盖创面 |
| 关节软骨修复 | 需抑制炎症(白细胞介素)与促进基质合成(TGF-β),保留白细胞活性 | CGF凝胶块填充软骨缺损 |
CGF提取的注意事项
- 无菌操作:全程在无菌台内操作,离心管、器械均需无菌消毒,避免细菌污染导致感染;
- 避免溶血:采血后轻柔混匀,避免剧烈震荡;离心时平衡对称放置,防止机械性溶血;
- 个体化调整:对于贫血、血小板减少患者,需增加采血量或调整离心参数(如适当提高离心速度);
- 即时使用:CGF凝胶提取后最好在2小时内使用,若需储存,应将CGF膜/凝胶块置于-20℃以下(避免反复冻融),储存时间不超过1个月。
相关问答FAQs
Q1:CGF提取过程中如何避免污染?
A:避免污染需从“人、机、料、法、环”五方面控制:①操作人员需戴无菌手套、口罩,手部严格消毒;②使用一次性无菌耗材(采血管、离心管、器械),避免交叉感染;③离心机、操作台定期消毒(75%酒精擦拭),环境保持洁净(层流净化台更佳);④血液采集与提取过程严格无菌操作,避免样本暴露过久;⑤CGF制备后若需储存,需使用无菌密封容器,标注患者信息与时间。
Q2:CGF提取失败(如未形成凝胶或凝胶破碎)的可能原因及解决方法?
A:常见原因及解决如下:①抗凝剂比例过高:重新调整ACD-A与血液比例(严格1:6),采血后立即混匀;②离心参数错误:检查离心机转速与时间设置,确保符合“低速-高速-低速”程序;③血液样本溶血:重新采血,避免震荡或使用过大针头采血;④储存温度不当:提取后室温放置过久(>2小时)或低温(<-20℃)导致活性丧失,需即时使用或规范储存;⑤患者个体差异:如血小板功能异常(服用抗凝药物、肝病等),需术前检测血小板功能,必要时调整离心参数(如提高第二阶段离心速度至3000 rpm)。