种植牙作为目前修复牙列缺损的理想方式,其成功与否很大程度上依赖于牙槽骨的骨量充足,当患者存在骨缺损时,自体骨移植因具有良好的生物相容性和成骨活性,成为骨增量治疗的“金标准”,自体骨移植术后可能出现吸收问题,即“种牙自体骨吸收”,这不仅影响骨增量效果,还可能威胁种植体的长期稳定性,本文将详细解析自体骨吸收的定义、发生机制、影响因素及防治策略,为临床实践和患者认知提供参考。
自体骨吸收的定义与临床特征
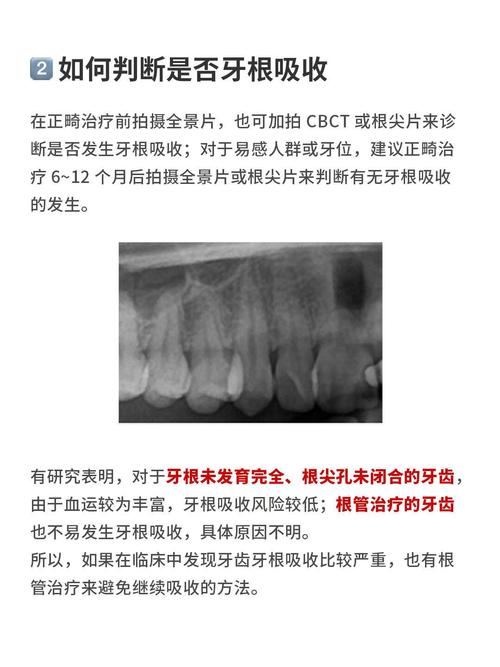
自体骨吸收是指移植的自体骨组织在宿主骨床愈合过程中,发生骨量减少、骨结构破坏的生理或病理性改建过程,根据发生时间,可分为早期吸收(术后1-3个月)和晚期吸收(术后3个月以上),早期吸收主要与手术创伤、血供重建延迟有关,表现为移植骨边缘模糊、密度降低;晚期吸收则多与骨改建失衡、机械刺激不足相关,可导致移植骨体积显著缩小,甚至影响种植体植入位置和稳定性。
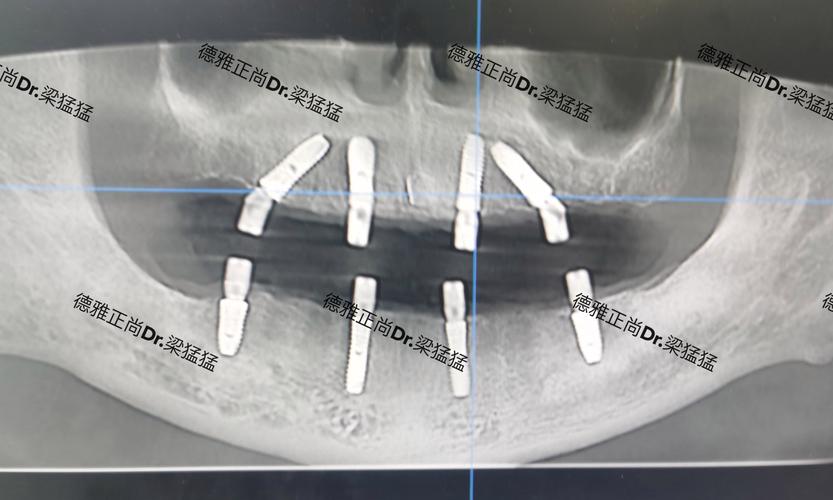
临床研究显示,自体骨移植的吸收率存在较大差异:下颌骨块状骨移植的吸收率约为20%-40%,而上颌骨因血供较差,吸收率可能高达30%-50%,若吸收过度(剩余骨量<种植体所需),则需二次植骨,延长治疗周期并增加患者痛苦。
自体骨吸收的核心原因
自体骨吸收是多种因素共同作用的结果,涉及生物学、手术技术及患者自身条件等多个层面。
生物学因素:骨改建失衡的关键
骨移植后的愈合本质是“爬行替代”过程,即宿主血管长入移植骨,破骨细胞吸收死骨,成骨细胞形成新骨,当这一过程失衡时,吸收便占据主导。
- 破骨细胞过度激活:手术创伤引发的局部炎症反应会释放白细胞介素-1(IL-1)、肿瘤坏死因子-α(TNF-α)等细胞因子,激活破骨细胞,若移植骨与宿主骨接触不良,或存在微动,会进一步加剧破骨细胞活性,导致过度吸收。
- 成骨细胞功能不足:自体骨中的成骨细胞在移植后因缺血缺氧发生凋亡,若宿主骨床的成骨细胞活性不足(如老年人、骨质疏松患者),新骨形成速度将滞后于吸收速度,表现为“净吸收”。
手术技术因素:可控却易被忽视的环节
手术操作直接影响移植骨的存活与愈合,技术缺陷是导致吸收的常见原因。

- 移植骨处理不当:过度切削、加热(如使用高速手机骨磨)可损伤骨细胞活性,降低成骨能力;骨块过大(直径>5cm)或过薄(<2mm)则易因血供不足导致骨坏死,引发吸收。
- 受区条件不佳:受区骨床血供不足(如放疗后骨、曾感染骨)、软组织张力过大(无法无张力缝合),或存在感染(如牙周炎未控制),均会影响移植骨的血管化,导致吸收。
- 固定与稳定性不足:移植骨未妥善固定(如钛板固定不牢)或过早承受咬合力,会造成微动,干扰骨愈合,诱发机械性吸收。
患者相关因素:个体差异的直接影响
患者自身状况是决定移植骨预后的基础因素。
- 年龄与全身健康状况:老年人骨改建能力下降,骨质疏松患者骨密度低,成骨活性减弱;糖尿病患者的微循环障碍会影响血供,增加吸收风险。
- 生活习惯:吸烟是自体骨吸收的高危因素,尼古丁会导致血管收缩,减少移植骨血供;饮酒可能影响成骨细胞功能,延缓愈合。
- 药物影响:长期使用糖皮质激素会抑制成骨细胞活性,抗凝药物可能影响局部血凝,不利于骨愈合。
自体骨吸收的影响因素(表格总结)
| 因素类别 | 具体因素 | 影响机制 | 临床意义 |
|---|---|---|---|
| 生物学因素 | 炎症因子过度释放 | 激活破骨细胞,加速骨吸收 | 术后抗炎治疗可降低早期吸收风险 |
| 成骨细胞功能不足 | 新骨形成滞后,净吸收增加 | 骨质疏松患者需术前预处理 | |
| 手术技术因素 | 移植骨过大/过薄 | 血供不足,骨坏死 | 移植骨块直径建议<3cm,厚度≥2mm |
| 受区血供差 | 血管化延迟,骨细胞凋亡 | 避免在放疗骨、感染区移植 | |
| 移植骨固定不稳 | 微动干扰骨愈合,机械性吸收 | 术中确保固定稳定,术后避免过早负重 | |
| 患者相关因素 | 吸烟 | 血管收缩,减少血供 | 术前至少戒烟4周,术后避免吸烟 |
| 糖尿病 | 微循环障碍,成骨能力下降 | 控制血糖后再手术,术后监测血糖 | |
| 长期使用糖皮质激素 | 抑制成骨细胞活性 | 评估用药风险,必要时调整药物 |
自体骨吸收的预防与处理策略
预防措施:从源头降低吸收风险
- 术前精准评估:通过CBCT测量骨缺损量、评估骨密度,排除未控制的牙周炎、糖尿病等全身病;对吸烟患者,要求术前戒烟4周以上。
- 优化手术技术:
- 移植骨获取时使用环钻或超声骨刀,减少机械损伤;骨块修整时保留足够松质骨(利于血管化)。
- 受区预备时确保新鲜出血(判断血供良好),必要时采用骨皮质开窗(促进血管长入)。
- 移植骨妥善固定(钛板钛钉),避免微动;软组织需无张力缝合,确保血供。
- 辅助技术应用:
- 引导骨再生(GBR):联合生物膜(如胶原膜)隔离软组织,防止纤维组织侵入,为骨愈合提供空间。
- 富血小板血浆(PRP):利用生长因子(PDGF、TGF-β)促进成骨细胞增殖和血管化,降低吸收率。
- 骨代用品复合:将自体骨与骨替代材料(如羟基磷灰石)混合,减少自体骨用量,降低吸收风险。
处理策略:根据吸收程度个体化干预
- 轻度吸收(吸收率<20%):无需特殊处理,通过调整种植体植入位置(如略微加深植入)即可,术后定期复查(术后3、6、12个月CBCT监测)。
- 中度吸收(20%-40%):若剩余骨量仍满足种植需求,可同期植入种植体,结合GBR技术;若骨量不足,需延期3-6个月,待骨改建稳定后再植骨。
- 重度吸收(>40%):需二次植骨,可选用自体骨(如髂骨)或骨替代材料(如磷酸三钙),术后延长无负重时间(3-6个月),避免咬合力干扰。
相关问答FAQs
Q1:自体骨吸收后种植牙一定会失败吗?
A1:不一定,自体骨吸收是否导致种植失败,取决于吸收程度、剩余骨量及种植体稳定性,若吸收轻微(<20%),剩余骨量仍能支持种植体,且种植初期稳定性良好(ISQ>60),通过调整修复方案(如延长愈合时间、使用更粗的种植体),仍可长期成功;若吸收严重(>40%)导致种植体骨结合丧失(如种植体松动、周围骨吸收),则可能失败,需取出种植体重新治疗。
Q2:如何判断自体骨移植后是否出现异常吸收?
A2:可通过临床和影像学综合判断:
- 临床症状:移植区牙龈红肿、疼痛、溢脓,或种植体松动、咬合不适,提示可能存在感染或过度吸收。
- 影像学检查:术后3个月CBCT显示移植骨密度显著降低(与术后1个月相比),骨小梁结构模糊,或种植体周围骨丧失>2mm,可诊断为异常吸收,需定期复查(术后1、3、6、12个月),动态监测骨量变化。
自体骨吸收是种植牙骨增量治疗中不可避免的挑战,但通过精准的术前评估、规范的手术操作及科学的术后管理,可有效降低其发生风险,临床医生需充分了解吸收机制,结合患者个体情况制定个性化方案,而患者需积极配合术前准备(如戒烟、控糖)和术后护理,共同保障种植牙的长期成功。